<< C&C project >>
>>George
Bacovia – Scântei Galbene<<
Termotehnică I
Capitolul I
INTRODUCERE
1.1.CONSIDERAŢII
GENERALE
Termodinamica este ştiinţa despre
energie în sensul cel mai larg al cuvântului. Obiectul ei este studiul
mişcării termice şi interdependenţa cu alte forme de
mişcare ale materiei.
Această
ştiinţă cuprinde:
·
Termodinamica fizică:
studiazăbazele teoretice generale, axiomatica şi sistematica
termodinamicii;
·
Termodinamica chimică: studiază
efectul termic al reacţiilor chimice;
·
Termodinamica tehnică: elaborează
teoria maşinii termice, prin studierea proceselor de transformare
reciprocă a căldurii şi a lucrului mecanic.
Transferul de
căldură este ştiinţa proceselor spontane ireversibile ale
propagării căldurii în spaţiu şi reprezintă schimbul
de energie termică între două corpuri, două regiuni ale
aceluiaşi corp, două fluide,ca rezultat al unei diferenţe de
temperatură dintre acestea.
Transferul de
masă este ştiinţa proceselor naturale ireversibile de
echilibrare a concentraţiei unui sistem alcătuit din unul sau mai
mulţi componenţi, prin transportul masei din zonele cu
concentraţii mai ridicate către cele cu concentraţii mai reduse.
1.2.NOŢIUNI
GENERALE
1.2.1. Sistem
termodinamic
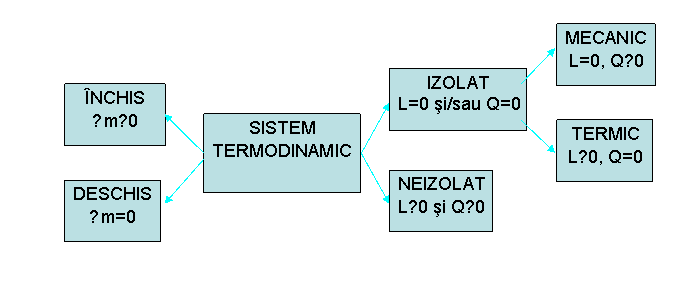
Prin sistem
termodinamic se înţelege un corp, un grup de corpuri sau o parte a unui
corp delimitat(ă) de erstul corpurilor care îl(o) înconjoară printr-o
suprafaţă de control (reală sau imaginară) prin care
sistemul poate să efectueze un schimb de energie (sub formă de
căldură, Q, şi/sau de lucru mecanic, L) şi/sau de masă
∆m. Celelalte corpuri, ce sunt în afara suprafeţei de control, se
consideră a fi mediul exterior sau mediul ambiant.
Clasificarea
sistemelor termodinamice se face după felul în care acestea
efectuează sau nu schimb de energie şi/sau de substanţă cu
mediul exterior şi se poate urmări, sintetic, în figura 1.
Fig. 1 Clasificarea sistemelor termodinamice
1.2.2. Stare. Parametri de stare
Starea unui sistem
termodinami reprezintă totalitatea proprietăţilo macroscopice ce
pot fi evidenţiate la un moment dat. Mărimile acestor
proprietăţi definesc parametrii de stare. Dacă parametrii de
stare sunt constanţi în timp, starea sistemului este o stare de echilibru
termodinamic. Parametrii de stare care descriu o stare de echilibru
termodinamic se numesc parametri termodinamici. Ei pot fi independenţi de
cantitatea de substanţă – în care caz se numesc intensivi
(temperatura, presiunea, etc.) – sau dependenţi de masă –
in care caz se numesc extensivi (volumul, entalpia, entropia, etc.)
Parametrii de stare
ce pot fi evidenţiaţi prin măsurători sunt
independenţi şi se numesc parametri fundamentali de stare iar cei
dependenţi de aceştia se numesc parametri derivaţi de stare.
Numărul
parametrilor independenţi necesari determinării unei stări, în
absenţa forţelor exterioare, este dat de relaţia lui Gibbs:
![]()
În care:
![]() este
numărul parametrilor independenţi;
este
numărul parametrilor independenţi;
![]() - numărul
componenţilor sistemului;
- numărul
componenţilor sistemului;
![]() - numărul
fazelor.
- numărul
fazelor.
Parametrii dependenţi ai sistemului
se determină în baza unor legităţi fizice, în funcţie de
cei independenţi.
Expresiile matematice ale acestor legi
fizice, care exprimă legătura între parametrii de stare
dependenţi şi cei independenţi, definesc ecuaţiile de stare
ale sistemului. Aceste ecuaţii pot fi exprimate sub formă:
-implicită: ![]() sau
sau
-explicită: ![]()
În care: ![]() este volumul specific, p – presiunea
şi T – temperatura.
este volumul specific, p – presiunea
şi T – temperatura.
Mărimile sau funcţiile de stare caracterizează starea de
echilibru a sistemului termodinamic şi admit diferenţială
totală exactă.
O mărime de stare, spre exemplu V(p,T),
are următoarele proprietăţi:
1.
Este diferenţiabilă:
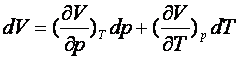 (1.2)
(1.2)
2. Derivatele
parţiale de ordinul doi, mixte, nu depind de ordinea de derivare:
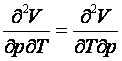 (1.3)
(1.3)
3. Este
integrabilă atăt pe o transformare deschisă cât şi pe una
închisă (ciclică), conform regulilor de integrare a funcţiilor
ce
admit diferenţială totală
exactă:
 ;
; ![]() (1.4)
(1.4)
În afara acestora
mai există mărimile sau funcţiile de transformare care depind de
evoluţia sistemului, nefiind deci diferenţiale
totale exacte. În acest caz, relaţiile
(1.4) devin:
 ;
;  ;
; ![]() ;
; ![]() (1.5)
(1.5)
în care prin L şi Q s-au notat lucrul mecanic şi respectiv căldura.
1.2.3. Definiţii şi unităţi de
măsură ale unor parametri de stare
Volumul specific
şi densitatea reprezintă volumul unităţii de masă
şi respectiv masa unităţii de volum, conform relaţiilor:
![]() ;
; ![]() (1.6)
(1.6)
Sistemul Internaţional de
unităţi utilizează pentru exprimarea cantităţii de
substanţă – în afară de kilogram – şi molul sau
kilomolul. În acest caz, volumul
unităţii de masă se notează cu ![]() şi se
numeşte volum (specific) molar:
şi se
numeşte volum (specific) molar:
![]() sau
sau
![]() (1.7)
(1.7)
în care
prin ![]() s-a notat cantitatea de substanţă exprimată în
moli sau kilomoli.
s-a notat cantitatea de substanţă exprimată în
moli sau kilomoli.
În condiţii
fizice normale (presiune fizică normală ![]() col Hg
– şi temperatură fizică normală TN =
273,15K):
col Hg
– şi temperatură fizică normală TN =
273,15K):
1[kmol]……cântăreşte….μ[kg]….ocupă……VM
= 22,14[m3]…..conţine…….NA
molecule
υ[kmol]……cântăreşte….m[kg[….ocupă……V[m3]………………conţine……N
molecule
în care NA este numărul lui Avogadro, NA
= 6,023∙1026 şi evident:
![]() (1.8)
(1.8)
Temperatura este un parametru fundamental
de stare care caracterizează starea termică a unui corp, mai exact, starea
de
echilibru
termodinamic. Condiţiile stării de echilibru termodinamic sunt
exprimate prin cele două postulate ale termodinamicii:
-Primul postulat, denumit şi principiul
general al termodinamicii, se referă la faptul că un sistem izolat
ajunge totdeauna, după
un interval de
timp, în starea de echilibru termodinamic şi nu poate ieşi, singur,
de la sine, din această stare. Conform acestui postulat, dacă un sistem izolat este
scos din starea de echilibru termodinamic, el va reveni la condiţiile
stării de echilibru
după un interval de timp, numit timp de relaxare.
-Al doilea
postulat,
numit şi principiul zero al
termodinamicii, precizează proprietăţile sistemului aflat în
stare de echilibru termodinamic, prin două formulări echivalente:
Ř
Orice mărime de stare a
unui sistem aflat în condiţii de echilibru termodinamic poate fi
determinată în funcţie de
parametrii de stare
externi ai sistemului şi de o mărime ce caracterizează starea
interioară a sistemului, numită
temperatură şi
Ř
Două sisteme termodinamice
aflate în echilibru termic cu un al treilea sistem, se găsesc în echilibru
între ele.
După cum reiese din enunţurile de mai sus,
acest postulat introduce temperatura ca parametru de stare intern,
caracteristic stării de echilibru şi precizează tranzitivitatea echilibrului termodinamic.
Măsurarea
temperaturii corpurilor este dificilă deoarece în natură nu
există o mărime etalon care să poată defini o unitate de
măsură absolută pentru temperatură. Pentru măsurarea
temperaturii sunt folosite unele proprietăţi fizice ale unor corpuri,
care se modifică sensibil în raport cu diferitele stări termice ale
acestora (dilatarea liniară şi volumică, apariţia unor
tensiuni electromotoare, variaţia intensităţii de radiaţie,
etc.).
Scara
termodinamică de temperatură, definită pe baza principiului al
doilea al termodinamicii, are originea în punctul zero absolut (la care
încetează mişcarea moleculelor). Temperatura termodinamică
(absolută) se notează cu T
şi se măsoară în Kelvin (K).
Scara
internaţională de temperatură, foloseşte ca unitate de
măsură pentru temperatură, notată cu t, gradul centigrad şi se măsoară în Celsius (oC).
Între
temperatura absolută şi temperatura măsurată în scara
internaţională există relaţia:
T =
t+273,15 [K] (1.9)
Presiunea reprezintă forţa de apăsare exercitată în
direcţie normală pe unitatea de suprafaţă a unui corp. În
cazul repartizării uniforme a forţei normale F pe suprafaţa de arie A,
presiunea se exprimă prin relaţia:
![]() [N/m2]
(1.10)
[N/m2]
(1.10)
____---Pagină în lucru ---____
Pe acest site puteţi găsi
informaţii despre emiţătoare FM, dar în primul rând acest site
este dedicat proiectelor.
<< C&C project >>